Phương pháp ôn thi, luyện thi đại học môn Hóa hiệu quả
Hóa học là môn có khối lượng lớn về kiến thức cả về thực nghi
Điều quan trọng nhất của quá trình ôn tập là thường xuyên hệ thống hóa kiến thức bằng mọi cách. Các sĩ tử nên làm đề cương và nắm chắc các lý thuyết tổng quát gồm:
Các thuyết và định luật: Thuyết nguyên tử - phân tử, thuyết electron, lý thuyết về liên kết hóa học, lý thuyết về phản ứng hóa học, thuyết điện li, thuyết cấu tạo hợp chất hữu cơ… Định luật bảo toàn khối lượng, định luật Avogadro, định luật tuần hoàn các nguyên tố hóa…
Ngoài ra cần phải nắm vững và thành thạo các phương pháp giải nhanh như: áp dụng định luật bảo toàn (bảo toàn khối lượng, bảo toàn electron, bảo toàn nguyên tố, bảo toàn điện tích…), phương pháp đường chéo, phương pháp dùng tăng giảm khối lượng…
Kiến thức Hóa học có đặc thù riêng là mang tính hệ thống và liên tục, không giống với môn Lý hay Toán có Điện - Quang - Cơ… hay Tổ hợp - Lượng giác - Hình không gian… hầu như không có mối liên hệ rõ ràng nào với nhau. Sự phân chia các nội dung Đại cương - Vô cơ - Hữu cơ trong Hóa học… chỉ để giúp cho người học dễ học, chứ không dễ ôn tập.
Khi ôn tập kiến thức Hóa học, điều tối quan trọng là các sĩ tử phải hệ thống, xâu chuỗi được nội dung mình đang ôn tập với các phần kiến thức có liên quan khác. Lý thuyết của Hóa học không cứng nhắc và cũng không giản đơn, không thể ôn tập bằng cách "đọc chay" hay "học vẹt" mà phải bằng cách luyện tập, thường xuyên ghi ra, viết ra, "gọi từ trong đầu ra" thì mới hiểu và nhớ lâu được.
Để làm được điều đó thì có một cách đơn giản là khi gặp bất kỳ câu hỏi nào, bài tập nào, các em hãy cố gắng không chỉ tìm cách giải quyết câu hỏi đó, bài toán đó mà còn tìm cách liên hệ với các kiến thức liên quan đến nó để nhớ lại, hồi tưởng lại.
Ví dụ: Hòa tan hoàn toàn 35,6 gam hỗn hợp X gồm NaBr và NaI vào nước, sau đó sục khí Cl2 tới phản ứng hoàn toàn rồi cô cạn dung dịch thu được 17,55 gam muối khan. Số mol NaBr và NaI trong hỗn hợp X lần lượt là:
A. 0,1 mol và 0,2 mol
B. 0,15 mol và 0,15 mol
C. 0,05 mol và 0,25 mol
D. 0,25 mol và 0,05 mol
Đáp án: A. 0,1 mol NaI và 0,2 mol NaBr.
Rõ ràng đây là một bài tập rất đơn giản và không có nhiều điều để bàn. Khi học hay khi làm bài kiểm tra, bài thi, các bạn chỉ dừng lại ở đây là đủ. Tuy nhiên, nếu đang trong giai đoạn ôn tập, các sĩ tử cần suy nghĩ nhiều hơn thế.
Bài toán còn có thể giải bằng cách nào khác nữa không?
Bài toán chắc chắn còn có thể giải được bằng phương pháp Trung bình kết hợp với Đường chéo, ngoài ra có thể giải được bằng cách "thử đáp án", các bạn có thể thay số lần lượt các kết quả từng đáp án vào, xem đáp án nào phù hợp với số liệu khối lượng của giả thiết.
Vấn đề Hóa học mà bài toán nêu ra là gì?
Bài tập này liên quan đến tính chất "Halogen mạnh đẩy Halogen yếu ra khỏi dung dịch muối của chúng": F2 > Cl2 > Br2 > I2 về tính oxi hóa.
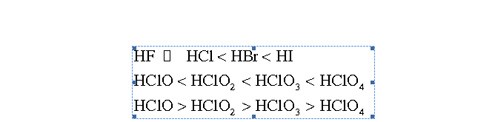
Ngoài ra, từ các tính chất trên, ta có thể đặt thêm câu hỏi: nếu các đơn chất halogen biến thiên như vậy, thì các hợp chất của chúng sẽ biến đổi như thế nào? - Trả lời cho câu hỏi này, chúng ta sẽ lại có thêm các dãy biến thiên:
Như vậy, chỉ thông qua một bài toán nhỏ và rất đơn giản, các bạn đã chủ động ôn tập lại được rất nhiều vấn đề quan trọng trong lý thuyết Hóa học. Chỉ cần áp dụng cách suy nghĩ trên cho các bài tập khác (lặp đi lặp lại trong các bài tập có vấn đề Hóa học tương tự), các bạn sẽ thấy rằng lý thuyết Hóa học phổ thông tuy rất rộng lớn và "tưởng như khó học, khó nhớ" thực ra lại có thể ôn tập và hệ thống rất dễ dàng chỉ thông qua một số ít các bài tập đơn giản.
Đây chính là phương pháp "học ít" mà mang lại "nhiều hiệu quả", giúp các sĩ tử vừa có thể ôn tập, nắm vững kiến thức trong thời gian ngắn, vừa tiết kiệm để dành thời gian và công sức ôn tập các môn học khác.
Bên cạnh đó, các em cần rèn luyện kỹ năng tính và phản xạ tư duy. Không phải bài toán nào cũng có cách giải đặc biệt nhanh, hoặc có công thức tính riêng. Để giải một bài toán thật nhanh và hiệu quả, việc trước tiên là phải rèn luyện kỹ năng tính và phản xạ tư duy. Các em không thể đòi hỏi việc giải nhanh một bài toán Hóa học nếu như chính các em không thể tính nhanh được từ những phép tính đơn giản nhất.
Các quy tắc nhân nhẩm, các dấu hiệu chia hết, xấp xỉ… là những kiến thức cơ sở mà bất kỳ học sinh nào cũng đã được học và nó cực kỳ hữu dụng cho bất cứ môn học nào, không chỉ giúp ta tính nhanh, tính nhẩm một số đại lượng trong bài toán mà đôi khi còn là giải pháp mang tính quyết định giúp bài toán được giải quyết nhanh gọn và hiệu quả hơn.
Ví dụ 1: Khử hoàn toàn 23,2 gam hỗn hợp FeO, Fe2O3 bằng H2 thu được 7,2 gam H2O. Thành phần phần trăm về khối lượng của mỗi oxit trong hỗn hợp là:
A. 31,03% FeO và 68,97% Fe2O3
B. 35,16% FeO và 64,84% Fe2O3
C. 41,24% FeO và 58,76% Fe2O3
D. 50,0% FeO và 50,0% Fe2O3
Nhận thấy 232 là KLPT của Fe3O4 (FeO.Fe2O3), do đó hỗn hợp ban đầu có khối lượng 23,2 gam (tương đương 0,1 mol Fe3O4) nhiều khả năng chứa 0,1 mol FeO và 0,1 mol Fe2O3.
Kiểm tra lại nhận định trên bằng cách tính số mol O:


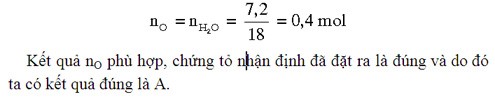
Thảo luận: